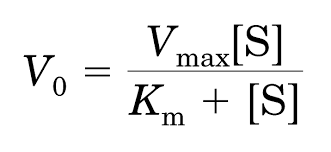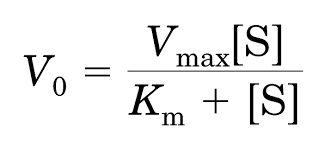AULA 2: Enzimas – Fundamentos, Cinética e Aplicações Biotecnológicas
1. Introdução: O Papel Central das Enzimas na Biologia Molecular
As enzimas são catalisadores biológicos altamente específicos, essenciais para sustentar a vida. Elas aceleram reações químicas que, de outra forma, ocorreriam em escalas de tempo incompatíveis com a existência celular. Diferentemente dos catalisadores inorgânicos, as enzimas operam sob condições fisiológicas suaves de temperatura e pH, com notável especificidade por seus substratos e regulação complexa.
A atividade enzimática está no cerne de processos bioquímicos como respiração celular, replicação do DNA, síntese de proteínas e metabolismo energético. Além disso, alterações nos níveis ou na função das enzimas estão frequentemente associadas a estados patológicos. Assim, o entendimento da estrutura, função e cinética das enzimas é essencial para as ciências médicas e farmacológicas.
2. Estrutura e Mecanismo de Ação Enzimática
2.1 O Sítio Ativo e a Especificidade Catalítica
O sítio ativo é uma cavidade tridimensional específica da enzima onde o substrato se liga e sofre transformação química. Essa interação ocorre por meio de forças não covalentes, como ligações de hidrogênio, forças hidrofóbicas e interações iônicas.
Existem dois modelos clássicos para explicar o reconhecimento entre enzima e substrato:
Modelo chave-fechadura: propõe complementaridade estrutural rígida.
Modelo de ajuste induzido (Koshland): a enzima sofre alterações conformacionais ao interagir com o substrato.
2.2 Cofatores, Coenzimas e Grupos Prostéticos
Muitas enzimas requerem componentes adicionais para exercer sua atividade:
Cofatores inorgânicos: íons metálicos como Mg²⁺, Zn²⁺.
Coenzimas orgânicas: NAD⁺, FAD, Coenzima A – frequentemente derivados de vitaminas.
Grupos prostéticos: coenzimas firmemente ligadas à enzima (ex: grupo heme da catalase).
2.3 Classificação das Enzimas
A IUBMB classifica as enzimas em seis grandes classes:
Oxidorredutases – reações de oxirredução
Transferases – transferência de grupos funcionais
Hidrolases – clivagem por adição de água
Liases – adição/remoção de grupos sem hidrólise
Isomerases – rearranjos intramoleculares
Ligases – formação de ligações com gasto de ATP
3. Cinética Enzimática Clássica
3.1 Curva de Saturação e Equação de Michaelis-Menten
A cinética enzimática descreve a velocidade de uma reação catalisada em função da concentração de substrato. A relação hiperbólica entre velocidade (v) e [S] é descrita pela equação de Michaelis-Menten:
Onde:
Vmáx: velocidade máxima, quando todos os sítios ativos estão ocupados
Km: constante de Michaelis, concentração de substrato na qual v = ½ Vmáx
[S]: concentração de substrato
Box – Interpretação fisiológica: Km indica a afinidade da enzima pelo substrato: quanto menor o Km, maior a afinidade.
3.2 Parâmetros Catalíticos
kcat (número de recambio): número de moléculas de substrato convertidas por enzima por segundo, em saturação.
Eficiência catalítica: razão usada para comparar enzimas diferentes ou mutações.
4. Cinética Avançada e Regulação Enzimática
4.1 Fatores que Afetam a Atividade Enzimática
pH: altera ionização dos grupos ativos
Temperatura: aumenta a energia cinética até certo ponto (desnaturação > 40 °C)
[Substrato]: modula velocidade até a saturação
4.2 Enzimas Alostéricas e Cooperatividade
Enzimas alostéricas possuem múltiplos sítios de ligação e exibem curvas sigmoides, típicas de proteínas com cooperatividade (ex: hemoglobina). Podem ser ativadas ou inibidas por efetores alostéricos.
4.3 Regulação por Feedback
Produtos finais de vias metabólicas frequentemente atuam como inibidores alostéricos das enzimas iniciais, evitando sobreprodução (ex: ATP inibe PFK-1 na glicólise).
5. Inibidores Enzimáticos
5.1 Inibição Reversível
Competitiva
Compete com o substrato pelo sítio ativo
Aumenta Km, Vmáx inalterado
Não competitiva
Liga-se a outro local da enzima
Vmáx reduzido, Km inalterado
Acompetitiva
Liga-se apenas ao complexo enzima-substrato
Reduz Vmáx e Km
5.2 Inibição Irreversível
Ligação covalente ou destruição do sítio ativo
Ex: penicilina, que inativa transpeptidase bacteriana
Figura sugerida: Gráficos Lineweaver-Burk comparando os três tipos de inibição
6. Enzimas como Marcadores no Diagnóstico Clínico
A presença ou o aumento de enzimas específicas no plasma é utilizado como indicador de lesão tecidual:
EnzimaOrigemUso diagnósticoALT/ASTFígadoHepatites, necrose hepáticaCK-MBMúsculo cardíacoInfarto agudo do miocárdioTroponinasCoraçãoMarcador mais sensível para IAMLDHCoração, fígado, músculoHemólise, IAM, lesões teciduaisAmilase/LipasePâncreasPancreatite aguda
Box – Aplicação clínica: A elevação da CK-MB e da troponina I em conjunto é altamente específica para dano cardíaco.
7. Inibidores Enzimáticos na Farmacologia
7.1 Mecanismo de Ação de Fármacos Inibidores
AAS (aspirina): inibe irreversivelmente a COX-1 e COX-2 → reduz prostaglandinas
Estatinas: inibem a HMG-CoA redutase → reduzem colesterol
Inibidores da ECA: impedem conversão de angiotensina I em II
Inibidores da MAO: utilizados em depressão e Parkinson
Inibidores da DPP-4: prolongam ação do GLP-1 no diabetes tipo 2
7.2 Inibidores Alvo-dirigidos em Oncologia
Ex: inibidores de tirosina quinase como o imatinibe (Leucemia Mieloide Crônica)
Box – Curiosidade: Mais de 50% dos fármacos aprovados atuam modulando atividade enzimática.
8. Aplicações Biotecnológicas e Terapias Baseadas em Enzimas
Asparaginase: usada no tratamento da leucemia linfoblástica aguda
DNase recombinante: usada na fibrose cística para fluidificar secreções
Uroquinase e alteplase: enzimas fibrinolíticas no tratamento do AVC isquêmico
PCR e enzimas de restrição: ferramentas centrais em biologia molecular
9. Patologias por Deficiência ou Disfunção Enzimática
Fenilcetonúria: mutação na fenilalanina hidroxilase
Doença de Tay-Sachs: deficiência de hexosaminidase A
Galactosemia: deficiência de GALT
G6PD: causa hemólise sob estresse oxidativo
Essas condições são classicamente chamadas de erro inato do metabolismo.
10. Conclusão: Enzimas Como Centro Funcional da Medicina Molecular
As enzimas são muito mais do que catalisadores: são os “interruptores moleculares” que regulam a vida celular. O conhecimento profundo de sua estrutura, cinética e regulação fornece a base para a compreensão de processos fisiológicos, o diagnóstico laboratorial moderno e o desenvolvimento racional de fármacos. No cenário clínico e farmacológico contemporâneo, as enzimas deixaram de ser apenas alvos de estudo e tornaram-se instrumentos ativos de diagnóstico, terapia e inovação biomédica.
11. Questões de Revisão
Explique o conceito de Km e sua relação com a afinidade da enzima pelo substrato.
Diferencie inibição competitiva, não competitiva e acompetitiva quanto ao efeito nos parâmetros cinéticos.
Cite três enzimas utilizadas como marcadores clínicos e seus respectivos tecidos de origem.
Como as estatinas atuam na regulação do colesterol plasmático?
Quais são os mecanismos pelos quais a temperatura e o pH afetam a atividade enzimática?
12. Glossário Técnico
Cinética enzimática: estudo da velocidade de reações catalisadas por enzimas.
Sítio ativo: região da enzima onde o substrato se liga e é transformado.
Cofator: componente não proteico essencial à atividade enzimática.
Km: concentração de substrato na qual a velocidade da reação é metade de Vmáx.
Inibidor enzimático: molécula que reduz ou bloqueia a atividade catalítica de uma enzima.